پیلهای سوختی مبدلهای انرژی ایستا میباشند که انرژی شیمیایی سوخت را به طور مستقیم به انرژی الکتریکی جریان مستقیم تبدیل میکنند. پیل های سوختی بر خلاف موتورهای احتراقی متداول، انرژی ناشی از یک سوخت را به طور مستقیم و بدون یک مبدل میانی (تبدیل به انرژی مکانیکی)، به انرژی الکتریکی تبدیل میکنند.
از شروع قرن بیست و یکم، تکنولوژیهای پیل سوختی رشد چشم گیری داشتهاند و تعداد واحدهای پیل سوختی نصب شده سریعاً در حال افزایش است. انتظار میرود که تکنولوژی پیل سوختی در نیمهی اول قرن بیست و یکم همانند کامپیوتر در نیمهی دوم قرن بیستم پیشرفت کند. اگرچه موانع زیادی مانند مسائل تکنولوژی و همچنین اقتصادی وجود دارد که قبل از اینکه پیل سوختی بتواند به عنوان منبع قابل اتکای انرژی در نظر گرفته شود، باید بر آنان غلبه کرد. انتظار میرود که در آینده با تحقیقات و بررسیهایی که روی پیلهای سوختی انجام میشود، در نیمه اول قرن بیستم پیل های سوختی به عنوان یک منبع قابل اطمینان و سریع مورد استفاده قرار گیرند.
اقتصاد هیدروژنی
اقتصاد هیدروژنی اشاره به اقتصادی دارد که در آن هیدروژن به عنوان سوخت تجاری با ارزش که میتواند بخش با ارزشی از مواد و خدمات مبتنی بر انرژی کشور در نظر گرفته شود. این دیدگاه بر پایهی دو انتظار استوار است:
- اینکه هیدروژن را بتوان از منابع انرژی داخلی به طوریکه به لحاظ اقتصادی بهصرفه بوده و از نظر محیط زیستی سالم باشد، تولید کرد؛
- اینکه فواید استفاده از پیل سوختی بر پایهی هیدروژن بتواند سهم بازار را در رقابت با منابع تولید انرژی مرسوم بدست آورد.
روند فزاینده استفاده از هیدروژن به عنوان حامل سوخت می تواند بسیاری از نگرانیهای استفاده از سوخت های فسیلی سنتی را، که شامل امنیت انرژی و کیفیت محیط زیست می باشد، سرو سامان بدهد. با وجود مزایای جذاب آن، گذار به اقتصاد هیدروژنی با چالش های چندگانه همراه است. عواملی نظیر تولید، بکارگیری، ذخیره، توزیع، انتقال و برنامههای تشویقی دولت برای ارتقاء اقتصاد هیدروژن بسیار اهمیت دارد.
هیدروژن کالایی است که برای حمل در مقیاس وسیع خواه به شکل مایع، خواه از طریق لوله یا سیلندرهای تحت فشار مشکلات عدیدهای دارد. بر مبنای وزن، هیدروژن ظرفیت انرژی بالاتری نسبت به بنزین دارد (120 مگاژول در کیلوگرم برای هیدروژن در برابر 44 مگاژول در کیلوگرم برای بنزین) اما بر مبنای حجم، ظرفیت انرژی بنزین خیلی بیشتر از هیدروژن است (3 مگاژول در لیتر برای هیدروژن در PSI 5000 و 8 مگاژول در لیتر برای هیدروژن مایع و 32مگاژول در لیتر برای بنزین).
اصول کلی عملکرد پیل های سوختی
ساختار کلی پیل سوختی شامل دو الکترود به نامهای آند و کاتد و یک ماده دیالکتریک در بین آنها می باشد. مولکول های هیدروژن و اکسیژن بر اساس واکنش زیر در شرایط استاندارد (1 اتمسفر و 25) با هم ترکیب شده و آب را تشکیل می دهند.
رابطه 1:
اساس این فرآیند که در شکل 1 نشان داده شده، به این صورت است که با تجزیه مولکول های هیدروژن به الکترونها و پروتونها با کمک یک کاتالیزور، پروتونها در الکترولیت از کاتد به سمت آند حرکت میکنند اما الکترونها نمیتوانند از این مسیر عبور کنند. الکترونها از طریق مدار الکتریکی خارجی (بار) حرکت میکنند تا مجدداً با پروتونهای هیدروژن و مولکولهای اکسیژن در کاتد ترکیب شوند و آب را تولید کنند.
شکل 1: اساس عملکرد یک پیل سوختی با فلوی پروتون درون الکترولیت

انواع پیل های سوختی
پیل های سوختی بطور کلی با توجه به نوع ماده الکترولیت مورد استفاده به دستهی دما-پایین و دما-بالا طبقه بندی میشوند. پیلهای سوختی دما-پایین عموماً محدود به °C 200 یا کمتر از آن هستند. متدا ولترین پیلهای سوختی دما-پایین، پیل سوختی آلکالین[1](AFC)، پیل سوختی فسفریک اسید[2] (PAFC) و پیل سوختی غشاء الکترولیتی پلیمری[3] یا غشاء تبادل پروتون[4] (PEMFC) هستند. در پیلهای سوختی دما-بالا، مونوکسید کربن و هیدروکربنها مثل CH4 میتوانند در داخل پیل به هیدروژن تبدیل شوند و یا مستقیماً اکسید شوند. رایج ترین این نوع پیلها، پیل سوختی کربنات مذاب[5] (MCFC) با دمای کارکرد °C 600-700 و پیل سوختی اکسید جامد[6] (SOFC) با دمای کارکرد °C 600-1000 میباشند.
جدول 1 مقایسه ای بین اجزای تشکیل دهنده و حالتهای عملیاتی پنج نوع پیلسوختی بیان شده را نشان میدهد. جدول 2 به طور خلاصه مزایا و عملکرد و کاربردهای پیلهای سوختی را ارائه میکند.
جدول 1. مقایسه اجزای مهم و ویژگیهای انواع مختلف پیلهای سوختی
|
اجزاء |
AFC |
PAFC |
PEMFC |
MCFC |
SOFC |
|
الکترود |
فلزات واسطه |
کربن |
کربن |
نیکل و اکسید نیکل |
فلز سخت |
|
کاتالیزور |
پلاتینیوم |
پلاتینیوم |
پلاتینیوم |
فلزات بجز فلزات نجیب |
فلزات بجز فلزات نجیب |
|
الکترولیت |
هیدروکسید پتاسیوم |
اسید فسفریک مایع |
پلیمر جامد (غشاء تبادل پروتون) |
کربنات مذاب |
سرامیک |
|
محدوده دمایی °C |
80-260 |
~200 |
50-80 |
600-700 |
600-1000 |
|
حامل شارژ (یون) |
OH |
H+ |
H+ |
CO32 |
O2 |
|
مدیریت تولید آب |
تبخیری |
تبخیری |
تبخیری |
بهصورت گاز |
بهصورت گاز |
|
مدیریت تولید گرما |
گاز فرآیندی |
گاز فرآیندی + خنکسازی مایع یا تولید بخار |
گاز فرآیندی + خنکسازی مایع |
رفورمینگ داخلی + گاز فرآیندی |
رفورمینگ داخلی + گاز فرآیندی |
جدول 2. مقایسه انواع مهم پیلهای سوختی
|
نوع |
AFC |
PAFC |
PEMFC |
MCFC |
SOFC |
|
نیاز به رفورمینگ داخلی |
خیر |
خیر |
خیر |
بله |
بله |
|
تلرانس CO |
غیر سمی (<50ppm) |
غیر سمی (<1%) |
غیر سمی (<50ppm) |
بله (سوخت) |
بله (سوخت) |
|
راندمان الکتریکی |
~ 50% |
~ 40% |
40-50 % |
45-55 % |
50-60 % |
|
محدوده چگالی توان (mW/cm2) |
150-400 |
150-300 |
300-1000 |
100-300 |
250-350 |
|
محدوده توان (kW) |
1-100 |
50-1000 |
001/0-1000 |
100-105 |
5-105 |
|
کاربرد |
منابع تغذیه فضایی، تولید پراکنده |
تولید پراکنده، نیروگاههای تولید همزمان |
پرتابل، حمل و نقل (خودروها)، تولید پراکنده |
تولید پراکنده، نیروگاههای تولید همزمان |
پرتابل، حمل و نقل، تولید پراکنده، نیروگاههای تولید همزمان |
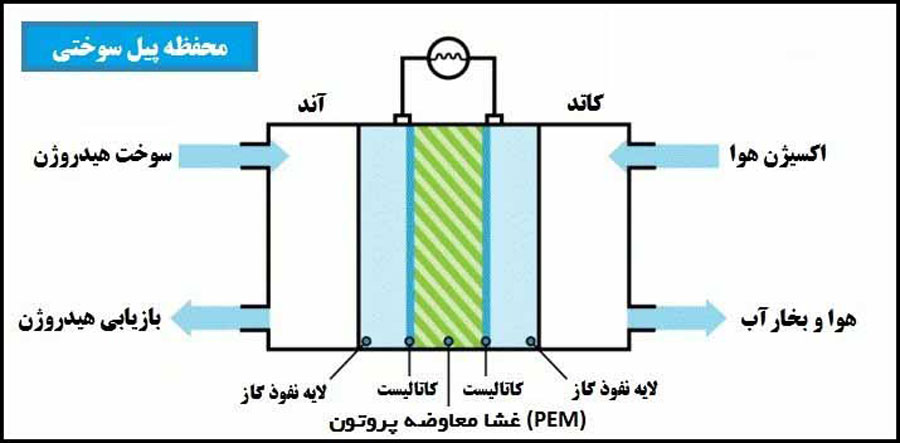
پیلهای سوختی PEM معمولا از پلیمر جامد (پلیمر اسید سولفوریک فلوراید یا پلیمرهای مشابه دیگر) به عنوان الکترولیت استفاده میکنند. مولکولهای هیدروژن با کمک کاتالیستهای پلاتینیوم در آند به الکترون و پروتون هیدروژن تجزیه میشوند. پروتونهای هیدروژن از میان لایه الکترولیت عبور کرده و به سطح کاتد میرسند. در آنجا با الکترونهایی که از طریق مدار خارجی از آند به کاتد رسیده اند، ترکیب میشوند و آب تشکیل میشود. شکل2، دیاگرام شماتیک و واکنش های شیمیایی پیلسوختی PEM را نشان میدهد.
شکل 2: دیاگرام شماتیک و واکنش های شیمیایی PEMFC

پیلهای سوختی PEM چگالی توان بالایی دارند و سریع شروع به کار میکنند و بازده الکتریکی آنها در محدوده 40 تا 50 درصد میباشد و دارای ویژگی راهاندازی سریع نیز هستند.
3-2-1- مدار معادل پیل های سوختی
معادله NERNST ولتاژ هر سلول پیل سوختی را توسط رابطه 1 بیان میکند:
رابطه 1:

که در آن؛
|
Ecell |
ولتاژ لحظهای NERNST (V) هر سلول |
T |
دمای مطلق (K) |
|
E0,cell |
ولتاژ بی باری استاندارد (V) هر سلول |
فشار جزئی هیدروژن (atm) |
|
|
F |
ثابت فارادی (C/kmol) |
فشار جزئی آب (atm) |
|
|
R |
ثابت گازها (1 atm)/(kmol.K) |
فشار جزئی اکسیژن (atm) |
به طور کلی ولتاژی که در ترمینالهای هر سلول پیل سوختی قرار میگیرد، از ولتاژی که در داخل پیل سوختی ایجاد می شود کمتر است. این امر در اثر افت ولتاژ فعالسازی[7]، افت ولتاژ اهمی[8] و افت ولتاژ اشباع[9] ایجاد میگردد که در شکل 3 نشان داده شده است. این افت ولتاژها تابعی از جریان بار و دمای و یا فشار پیل سوختی میباشد. افت ولتاژ اهمی، یک تابع خطی از جریان بار پیل سوختی می باشد اما مقاومت اهمی (Rohm,cell) معمولا تابعی از دمای پیل سوختی است. افت ولتاژهای فعالسازی و اشباع، تابعی غیرخطی از جریان بار و همچنین فشار و یا دمای داخلی پیل سوختی میباشد.
شکل 3: مدار معادل الکتریکی پیل سوختی

می توان ولتاژ خروجی پیل سوختی را به صورت زیر بیان کرد.
 که در آن، Vcell و Ecell به ترتیب ولتاژ خروجی و ولتاژ داخلی پیل سوختی و Vact,cell، Vohm,cell و Vconc,cell افت ولتاژهای ذکر شده میباشند. علاوه بر جریان بار پیل سوختی، فشار و دما، ظرفیت ذخیره انرژی الکتریکی پیلهای سوختی معمولا پاسخ دینامیکی آنها را تحت تاثیر قرار میدهند. این اثر که برای اکثر پیلهای سوختی رایج است، باعث میشود که آنها مثل یک خازن بزرگ (در حدود چند فاراد) عمل کنند که به آنها خازن اثر شارژ دو لایه[10] گفته میشود.
که در آن، Vcell و Ecell به ترتیب ولتاژ خروجی و ولتاژ داخلی پیل سوختی و Vact,cell، Vohm,cell و Vconc,cell افت ولتاژهای ذکر شده میباشند. علاوه بر جریان بار پیل سوختی، فشار و دما، ظرفیت ذخیره انرژی الکتریکی پیلهای سوختی معمولا پاسخ دینامیکی آنها را تحت تاثیر قرار میدهند. این اثر که برای اکثر پیلهای سوختی رایج است، باعث میشود که آنها مثل یک خازن بزرگ (در حدود چند فاراد) عمل کنند که به آنها خازن اثر شارژ دو لایه[10] گفته میشود.
3-2-2- خازن اثر شارژ دو لایه
در پیل های سوختی، دو الکترود توسط الکترولیت از هم جدا شده اند و دو لایه مرزی تشکیل شده است که لایه های آند-الکترولیت و کاتد-الکترولیت میباشند. این دو لایه باردار با پلاریته مخالف یک مرز بین الکترولیت و الکترودها تشکیل میدهند. این لایه ها به عنوان لایههای دوبل الکتروشیمیایی شناخته شده اند که می توانند انرژی الکتریکی را ذخیره کنند و همانند یک خازن عمل نمایند. شکل 4 (سمت چپ) یک نمونه از چگونگی قرارگیری یونهای منفی و مثبت در سطح متخلخل الکترود و اثر خازنی ایجاد شده را نشان میدهد.
شکل 4: اثر شارژ دولایه در یک الکترود پیل سوختی صفحه ای و مدار معادل آن

معادله 3:

در معادله 3، ε ثابت دی الکتریک الکترولیت، A سطح موثر بین الکترولیت و الکترودها و l فاصله بین لایهها است. در یک پیل سوختی واقعی به خاطر ساختار متخلخل الکترودها، A بزرگ و l خیلی کوچک (در حد نانومتر) میباشد که موجب بزرگ شدن ظرفیت خازنی(در حدود صدها میکروفاراد تا چند فاراد) میگردد. مدار معادل پیل سوختی شکل 3 برای نشان دادن اثر شارژ دولایه، میتواند به صورت شکل 4 (سمت راست) اصلاح شود. در این شکل Ract,cell، Rohm,cell و Rconc,cell، مقاومتهای فعالسازی، اهمی و اشباع میباشند. این پارامترها در فصل آینده برای پیل سوختی PEM ارائه خواهد شد. از شکل 4 میتوان ولتاژ خازن را به صورت زیر بیان نمود.
رابطه 4:

طبق شکل 4 و رابطه 4، تنها مقاومتهای فعالسازی و اشباع روی ثابت زمانی مدار اثر میگذارند ( ). این امر به این دلیل است که اثر واکنشهای الکتروشیمیایی داخل پیل سوختی تنها بر روی این دو مقاومت تغییر ایجاد مینماید و مقاومت اهمی، مقاومتی است که در اثر افت ولتاژ اهمی لحاظ شده است. ولتاژ خروجی پیل سوختی می تواند به صورت زیر بیان شود.
رابطه 5:

با توجه به رابطه 5 ولتاژ خروجی پیل سوختی مقداری متغیر دارد زیرا تابعی از زمان با ثابت زمانی زیر است.

[1] Alkaline Fuel Cell
[2] Phosphoric Acid Fuel Cell
[3] Polymer Electrolyte Membrane Fuel Cell
[4] Proton Exchange Membrane Fuel Cell
[5] Molten Carbonate Fuel Cell
[6] Solid Oxide Fuel Cell
[7] Activation Voltage Drop
[8] Ohmic Voltage Drop
[9] Concentration Voltage Drop
[10] Capacitance of Double Layer Charge Effect